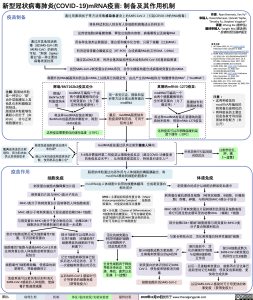
新型冠状病毒肺炎(COVID-19)mRNA疫苗: 制备及其作用机制
作者: Ryan Brenneis, Yan Yu* 审稿人: Davis MacLean, Hannah Yaphe, Timothy Fu, Stephen Vaughan* 译者: Zihong Xie (谢梓泓) 翻译审稿人: Yonglin Mai (麦泳琳) * 发表时担任临床医生
参考文献
1. ACS Nano 2020, 14, 10, 12522–12537, Publication Date: October 9, 2020, https://doi.org/10.1021/acsnano.0c07197
2. NEJM 2020, Publication Date: December 10, 2020, DOI: 10.1056/NEJMoa2034577
3. Expert Review of Vaccines 2017, 16, 9, 871-881, Publication Date: 2017, DOI: 10.1080/14760584.2017.1355245
4. NEJM 2020, 383, 2439-2450, Publication Date: December 17, 2020, DOI: 10.1056/NEJMoa2027906
5. NEJM 2020, 383, 2427-2438, Publication Date: December 17, 2020, DOI: 10.1056/NEJMoa2028436
6. BMJ 2000, 321, 7271, 1237-1238, Publication Date: November 18, 2000, DOI: 10.1136.bmj.321.7271.1237
注意:
• 这两种疫苗的 modRNA所编码的 刺突蛋白是相似的
• 两种疫苗的主要区 别是各家专利的脂 质纳米粒配方(未 公开)
注射部位红、 肿、痛 (一过性)
疫苗制备
通过用鼻咽拭子等方法采集感染患者身上的SARS-CoV-2(引起COVID-19的RNA病毒) 将各种试剂加入到含有人体细胞和病毒成分的样本中 试剂使细胞/病毒膜溶解,释放出细胞内容物、病毒颗粒以及病毒RNA 用各种洗涤剂去除脂肪、蛋白质和碳水化合物,只留下核酸(比如RNA) 利用逆转录聚合酶链反应(RT-PCR)合成病毒RNA的互补DNA(cDNA) 通过其cDNA文库,利用全基因组测序技术绘制SARS-CoV-2的基因组图谱 找到SARS-CoV-2刺突蛋白的DNA序列,并作为模板构建合成病毒刺突蛋白的mRNA 将额外的RNA碱基添加到这条mRNA上以提高它的稳定性,由此产生的RNA链称为“核酸修饰的RNA”(“modRNA”)
用一系列沉淀、提取和层 析等方法分离出刺突蛋白 modRNA
最后,modRNA脂质纳米 粒疫苗研制完成,可用于 肌肉注射
modRNA疫苗通过肌肉注射到健康人体内 3-4周后需接种第二剂疫苗以增强免疫反应(超过COVID-19康复者
通过对其他冠状病 毒(如SARS-CoV-1和 MERS-CoV)的研究
可知,“刺突(Spike) 蛋白”是一种主要的
病毒表面抗原
辉瑞/BNT162b2疫苗成分:
莫德纳mRNA-1273疫苗:
注解: 脂质纳米粒 是一种空心“球”, 由外层脂膜加上其 他乳化剂和膜稳定 剂制成。 脂质纳米粒能够包 裹较小的分子(如 RNA),并与正常 细胞膜结合。
肌肉是首选的注射 部位,因为肌肉血 供比其他组织多
疫苗作用
能使免疫细胞更快处理外 来抗原6
能让外来的疫苗物质更快扩 散,使局部反应最小化6
细胞免疫
的免疫反应水平),从而提高疫苗效力,特别是对老年人
4,5
外来异物可引起局部 炎症反应
辉瑞/ BioNTech专 利脂质纳米 粒
modRNA可编码一个由 两个脯氨酸修饰的全 长刺突蛋白(为了稳 定性和免疫原性)2
modRNA可编码一个 由两个脯氨酸修饰的 全长刺突蛋白(为了 稳定性)1
莫德纳专利 脂质纳米粒
将这种modRNA封装在辉瑞/ BioNTech的脂质纳米颗粒中,得到 162b2疫苗
这种疫苗需要更低的储存温度((-700C)
将这种modRNA封装在莫德纳的脂 质纳米粒种,得到mRNA-1273疫苗
这种疫苗可以在稍微温暖的温 度下储存(-200C)
刺突蛋白被胞内酶降解为片段
刺突蛋白片段与MHC-I类分子结合
MHC = 主要组织相容性复合体(Major Histocompatability Complex);细胞表 面蛋白,对免疫功能至关重要
CD = 分化簇(Cluster of Differentiation); T细胞表面的糖蛋白,可作为辅助受体, 促进T细胞与抗原/MHC复合物的结合, 同时可用来区分T细胞类型
刺突蛋白的成分从细胞内释放到血液中 刺突蛋白被抗原提呈细胞 (树突状细胞、B细胞、巨噬细
胞)吞噬、碎裂,与特异的MHC-II类分子结合 MHC-II类分子将刺突蛋白片段转移到抗原提呈细胞表面,
将它们提呈给血循环里的幼稚CD4+ (辅助)T细胞 部分幼稚CD4+ 辅助T细胞能够与刺突蛋白-MHC-II类
分子复合物顺利结合
与复合物结合后,活化刺突蛋白特异性辅助T细胞
脂质纳米粒通过内吞作用与人体细胞的磷脂膜融合,将
modRNA释放到细胞的胞浆中 体液免疫
modRNA由人体细胞中自带的核糖体翻译,合成刺突蛋白 相关成分
MHC-I类分子将刺突蛋白片段转移到人体细胞表面
MHC-I类分子将刺突蛋白片段呈递给幼稚CD8+ T细胞
与刺突蛋白-MHC-I类分子复合物结合后,幼稚CD8+ T 细胞活化并转移到淋巴系统进一步成熟
部分T细胞成熟后成为细胞毒性T细 胞,可识别刺突蛋白
细胞毒性T细胞与感染SARS-CoV-2并表 达刺突蛋白的人体细胞或刺突蛋白片 段结合
细胞毒性T细胞释放酶,使感染的细 胞穿孔,导致细胞死亡
免疫系统可以更快地识别和消灭 SARS-CoV-2感染的人体细胞,使病 毒扩散速度减缓
部分T细胞可以成熟为记 忆性T细胞 (在辅助性T 细胞释放的细胞因子的 刺激下)
记忆T细胞转移到淋巴组 织后进入待定状态,在下 一次接触刺突蛋白时活化
以后SARS-CoV-2 感染时可 介导更快的细胞免疫 (获得免疫力)
活化的刺突蛋白 特异性辅助T细胞 分泌细胞因子, 促进免疫活性
全身性细胞因子释放 导致全身反应:如发 烧、寒战、疲劳以及 肌痛 (一过性)
部分B细胞成熟为浆细胞,产 生病毒刺突蛋白的IgG抗体
刺突蛋白抗体识别标记SARS- CoV-2,使免疫系统能消灭病 毒
根除细胞外的SARS-CoV-2
淋巴组织中,活 化的辅助性T细胞 与幼稚B细胞相 互作用
部分B细胞成熟为 SARS-CoV-2刺突蛋白 特异性记忆B细胞
以后一旦接触刺突蛋白,就能再次活化淋巴 组织里的记忆B细胞,使其变成浆细胞,更 快地合成抗体
以后SARS-CoV-2 感染时可介导更快的体 液免疫 (获得免疫力)
图注:
病理生理
机制
体征/临床表现/实验室检查
最终结果
2020年12月19日发布于 www.thecalgaryguide.com